Naziv i šifra HRZZ projekta: Epigenetička regulacija glikozilacije imunoglobulina G
(Epigenetic regulation of IgG glycosylation); 3361
Akronim projekta: EpiGlycoIgG
Voditelj projekta: prof. Vlatka Zoldoš, Horvatovac 102a, Zagreb
Članovi istraživačke grupe: prof. Gordan Lauc (FBF), doc. Aleksandar Vojta (PMF), doc. Petra Korać (PMF), dr. sc. Ivana Samaržija (PMF), dr. sc. Vedrana Vičić Bočkor (PMF), mag. dipl. Paula Dobrinić (PMF), mag. dipl. Marija Klasić (PMF), mag. dipl. Dora Markulin (PMF), mag. dipl. Genadij Razdorov (FBF), mag. dipl. Toma Keser (FBF), mag.dipl. Vanja Tadić (PMF).
Ustanove suradnici: Prirodoslovno-matematički i Farmaceutsko-biokemijski fakultet Sveučilišta u Zagrebu
Projekt financira: Hrvatska zaklada za znanost
Trajanje projekta: 01/07/2014 - 01/07/2015
Sažetak:
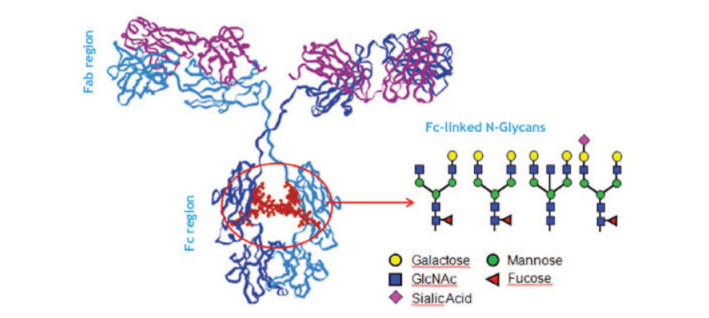
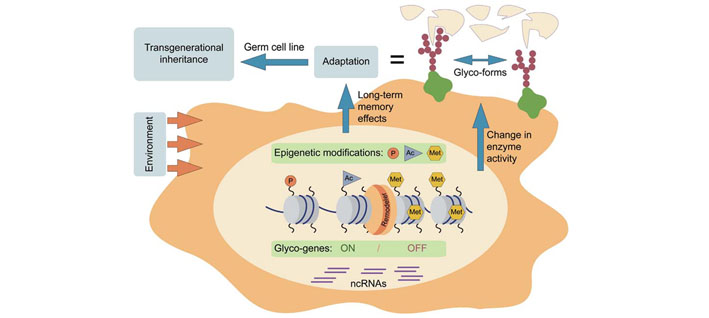
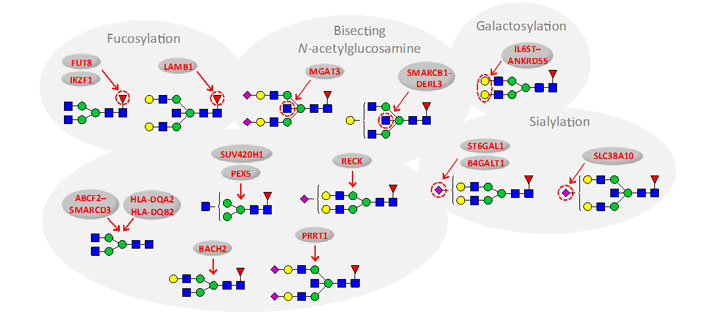
Imunoglobulin G (IgG) predstavlja jedan od glavnih elemenata imunog sustava. IgG je glikoprotein koji ima jedno glikozilacijsko mjesto na oba teška lanca. Prva cjelogenomska asocijacijska studija (GWAS) identificirala je složenu mrežu gena koja je potencijalno uključena u glikozilaciju IgGa. Plazma stanice sazrijevaju iz B limfocita i izlučuju IgG molekule. Regija Fab antitijela IgG definirana je nukleotidnim slijedom rano tijekom razvoja, međutim efektorska funkcija antitijela regulirana je glikozilacijom regije Fc tek kada B limfocit dođe u kontakt s određenim antigenom. Pretpostavlja se da različiti klonovi B limfocita pokazuju različiti uzorak IgG glikozilacije što sugerira da je uzorak glikozilacije (jednom kada se uspostavi) stabilan. Hipoteza je da je DNA metilacija, kao epigenetički mehanizam stanične memorij, uključena u fiksaciju uzorka IgG glikozilacije u različitim klonovima B limfocita.
U ovom projektu primijeniti će se nekoliko komplementarnih pristupa u svrhu funkcionalne validacije GWAS hitova povezanih sa IgG glikozilacijom, te u svrhu otkrivanja epigenetičkih regulatornih mehanizama koji bi mogli biti uključeni u fiksaciju stabilnog uzorka IgG glikozilacije u antigen specifičnim B limfocitima. Koristiti će se hibridoma stanice (mišji model imortaliziranih B limfocita) i limfoblastoične stanice (ljudski model imortaliziranih B limfocita). Za funkcionalnu validaciju koristiti će se metoda genetičkog i epigenetičkog editinga, CRISPR-Cas9. Epigenetički editing će se validirati pirosekvenciranjem. Očekujemo dobiti vrijedne rezultate koji ukazuju na važnost GWAS hitova (BACH2, LAMB1, IL6ST, MGAT3 i IKZF1) u regulaciji glikozilacije IgG antitijela. Također, očekujemo da će funkcionalne studije koje uključuju gen HNF1A, provedene na HepG2 stanicama, otkriti njegovu ulogu u regulaciji fukoziliranih i razgranatih glikanskih struktura, koje su važno promjenjeni u dijabetesu tipa MODY.
Ciljevi:
Alternativna glikozilacija imunoglobulina G značajno mijenja funkciju ovog antitijela. Cjelogenomske asocijacijske (GWA) studije otkrile su potencijalne genske lokuse uključene u glikozilaciju imunoglobulina G. GWAS lokusi povezani sa IgG glikozilacijom su:
BACH2 (transkripcijski faktor uključen u diferencijaciju, sazrijevanje i aktivaciju B limfocita)
IL6ST (signalni transporter citokina)
IKZF1 (protein Ikaros, transkripcijski faktor uključen u diferencijaciju B limfocita)
MGAT3 (manoza beta -1,4-N-acetilglukozaminiltransferaza)
LAMB1 (glikoprotein staničnog matriksa)
Opći cilj je istražiti na koji način su ovi genski lokusi uključeni u uspostavljanje glikozilacije na regiji Fc imunoglobulina G, te otkriti koji su mehanizmi odgovorni za održavanje specifičnog uzorka IgG glikozilacije.
Specifični ciljevi:
- Konstruirati CRISPR alate za knock-out genskih lokusa BACH2, IL6ST, IKZF1, MGAT3, LAMB1 i HNF1A.
- Funkcionalna studija GWAS lokusa na modelu hibridoma stanica i limfoblastoma (humani model).
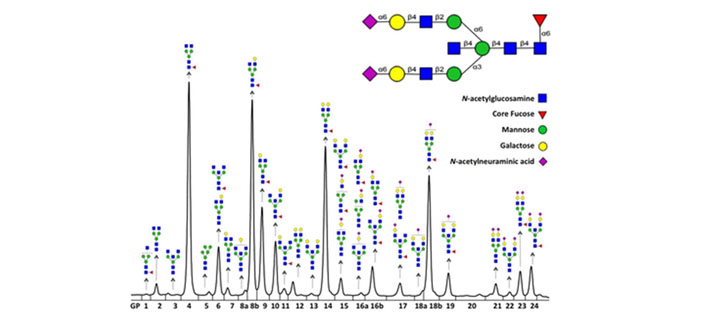
- Analiza N-glikana na IgG antitijelima izlučenim iz hibridoma stanica nakon utišavanja ciljnih genskih lokusa.
- Konstrukcija epi-CRISPRa za gen HNF1A (transkripcijski faktor i master regulator fukozilacije glikoproteina).
- Funkcionalna validacija epi-CRISPRa za HNF1A u HepG2 stanicama te korelacija s N-glikomom izlučenog imunoglobulina G.

 Pristupačnost
Pristupačnost